Pour réaliser ma petite protégée, il vous faudra du lait ou encore de la crème, ou même de la crème de lait pour les plus téméraires. Des colorants alimentaires (mais si vous n’en n’avez pas, pas de panique, les cartouches d’encre ou la peinture à l’eau font aussi très bien l’affaire – j’avoue même que la peinture à l’eau est mon petit chouchou, donc si vous avez encore vos fournitures d’Arts Plastiques, vous avez maintenant une bonne raison de les sortir de votre armoire) et enfin du liquide vaisselle ou de la lessive à main (c’est même plus sympa avec de la lessive à main – comme quoi ne pas avoir de machine à laver peut être un avantage). Et voilà, si vous avez ces produits, vous êtes paré.e.s pour l’expérience.
Maintenant :
- Munissez-vous d’un bol, d’une assiette ou que sais-je de creux (si vous n’avez pas ça mais que vous avez tout le reste sachez que vous être bizarre !)
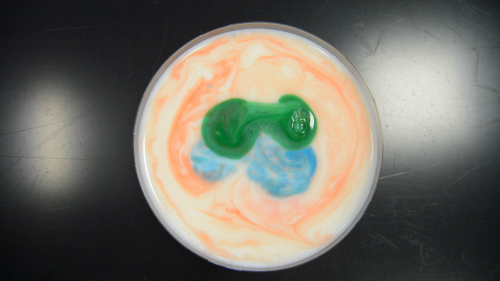
- Remplissez votre bol avec votre produit laitier fétiche, déposez-y quelques gouttes de peinture ou de colorant selon votre humeur (tout est possible, ne vous restreignez pas, vaporisez la peinture, faites des gouttes, des mélanges… bref, ce qui vous passe par la tête, mais visez bien le bol ! Le nettoyage, on aime pas ça…)
- Déposez ensuite dans votre récipient (où bon vous semble, au milieu d’une couleur ou dans une zone laitière) une goutte de produit vaisselle ou de lessive, et contemplez !
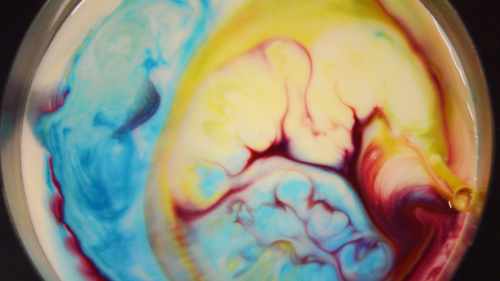
Avec le lait, la peinture va être propulsée le plus loin possible du liquide vaisselle, avec la crème ou la crème de lait, des petits canaux de peinture vont apparaître. N’est-ce pas sublime ? Moi j’adore ! Et pour recommencer l’expérience, pas la peine de changer son produit laitier, il suffit de mélanger (jusqu’à obtenir à nouveau quelque chose d’homogène, puis de recommencer), bien entendu, lorsque votre lait sera majoritairement composé de colorant, il est possible que l’expérience fonctionne moins bien, mais ça vous laisse une marge !

« avec la crème ou la crème de lait, des petits canaux de peinture vont apparaître. N’est-ce pas sublime ? Moi j’adore ! »
Maintenant, vous allez vraiment en prendre plein les yeux… Et n’oubliez pas d’en prendre plein la tête avec l’explication.
Vous êtes prêt.e.s ? C’est parti !



Premièrement, savez-vous ce qu’est la tension superficielle ? Non ? (si vous avez répondu oui, vous avez quand même le droit à un petit rafraîchissement de mémoire bonus !)
On y va doucement. Un liquide est composé de molécules (qui changent selon le liquide mais fonctionnent globalement de la même manière) et ces molécules sont toutes entourées d’autres molécules. Pour mieux comprendre, on va faire une petite analogie avec vous quand vous prenez le métro pendant les heures de pointe : il y a tellement de monde de tous les côtés que vous n’avez même pas besoin de vous tenir, le contact des voisin.e.s vous suffit à tenir debout. Et bien pour nos petites molécules c’est pareil, sauf qu’elles ont aussi des voisin.e.s de métro au dessus de leurs têtes et sous leurs pieds. La petite pression qu’on subit de la part de ses voisin.e.s et qui nous permet de tenir debout sans être attaché à son voisin (la preuve, vous pouvez, avec un peu de bonne volonté, glisser jusqu’à la porte du métro pour vous en extirpez) s’apparente aux interactions de Van Der Waals ou encore aux liaisons hydrogènes. Mais vous allez me dire : où est la tension superficielle ? Et vous avez raison, mais je voulais avant cela que vous compreniez comment fonctionne un liquide.
Les gaz fonctionnent sur la même analogie à la différence près que nos petites molécules peuvent se balader beaucoup plus librement, comme des biches dans un champ et qui changeraient de direction que lors d’une rencontre avec un arbre, une autre biche ou encore les barrières du champ (s’il y a des barrières).
- La tension superficielle tant attendue !
Les molécules de la surface ne sont pas entourées d’autres molécules du liquide comme leurs voisines du dessous. Pour compenser ce déséquilibre, les molécules de la surface vont tenir plus fortement les voisines de droite et de gauche : on dit qu’elles forment des liaisons fortes avec leurs voisines.
C’est grâce à ces liaisons fortes que la surface de l’eau se comporte comme une fine pellicule plastique et que les insectes peuvent se poser dessus ou qu’on peut y faire tenir une aiguille.
- Et le savon dans tout ça ?
Et bien le savon, qui est un dégraissant, permet à l’eau et l’huile de se mélanger entre eux. Essayer de mélanger de l’eau et de l’huile dans un verre, au bout de quelques secondes les des liquides reprennent leurs places bien distinctes. En revanche, si vous ajoutez du savon et que vous mélangez à nouveau, il faudra beaucoup plus de temps pour que les deux liquides se séparent à nouveau. Ce phénomène se déroule car le savon sépare nos petites molécules d’eau de surface en les empêchant de se tenir les mains. Ainsi, la surface de l’eau (ou du liquide) ne forme plus une petite pellicule, et l’insecte qui pouvait avant se poser, coule. Plus les molécules de surface se tiennent les mains fortement, plus la tension superficielle est élevée, mais plus leurs mains se relâchent, plus la tension superficielle est dite faible. Le savon baisse ainsi la tension superficielle dans la zone où il est déposé : on dit que c’est un tensioactif (il peut faire varier la tension superficielle d’un liquide).
Maintenant que la tension superficielle n’a plus (ou presque plus) de secrets pour vous, j’explique pourquoi nos colorants dansent comme ça.
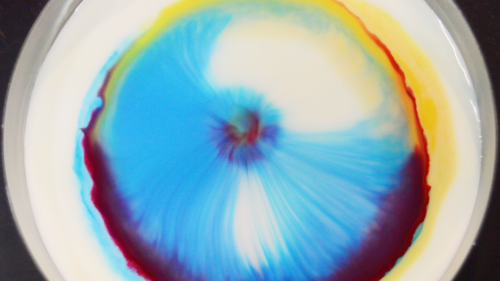
Nos colorants se sont déposés sur la tête de nos molécules de surface. Donc, en ajoutant le savon, nos molécules de liquide proches du savon vont se lâcher les mains, mais leurs copines proches des bords du récipient (qui elles sont relativement loin du savon) continuent de tenir la bordure du récipient et de tirer vers elles leurs copines. Les molécules proches de la goutte de savon vont donc être tirées vers les bords par leurs copines et tracter avec elles les pigments et les colorants qu’elles avaient sur la tête. Ainsi, nos petits pigments se déplacent vers les rebords de notre récipient.
Pour les « remous » que l’on peut observer quelques minutes après le début de la réaction, je les attribue à des mouvements de convections (le liquide est tracté vers les bords, sur lesquels il vient taper avant de plonger sous la surface du liquide pour ressortir plus loin encore chargé de quelques pigments, les mouvements peuvent être apparentés aux courants marins, sans chipoter avec la température) mais il y a certainement d’autres interactions qui rentrent en compte pour expliquer ses mouvements.
Petit plus : si l’expérience ne fonctionne pas indéfiniment même après avoir mélangé le liquide pour ré-équilibrer la tension superficielle, c’est parce que la tension superficielle obtenue après le premier ajout de savon est plus faible que la tension superficielle d’origine. Donc lorsque l’on dépose un peu de savon une deuxième fois, le contraste entre la tension superficielle des bords et celle autour du savon est encore plus faible, donc le déplacement des molécules est moins rapide et moins spectaculaire (mais pour éviter de gaspiller du lait ou de la crème, vous pouvez quand même reproduire l’expérience au moins 5 fois dans le même bol avant de changer votre lait).
















COMMENTAIRES